Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!
Questão ativa
Já visualizadas
Não visualizadas
Resolução pendente
Questão anulada
Sem alternativas

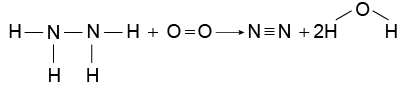
A hidrazina , substância utilizada como propelente de foguetes, sofre combustão conforme a equação:
A tabela apresenta alguns valores de entalpias de ligação envolvidas nessa reação.
| Ligação | Entalpia (kJ/mol) |
| N – H | 391 |
| N ≡ N | 949 |
| N – N | 163 |
| O = O | 497 |
| H – O | 463 |
Utilizando os dados tabelados, calcula-se que a combustão de 1 mol de hidrazina irá liberar
949 kJ.
1 727 kJ.
577 kJ.
2 224 kJ.
2 801 kJ.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!