Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!
Questão ativa
Já visualizadas
Não visualizadas
Resolução pendente
Questão anulada
Sem alternativas

Analise a tabela que apresenta o uso de algumas substâncias presentes no cotidiano.
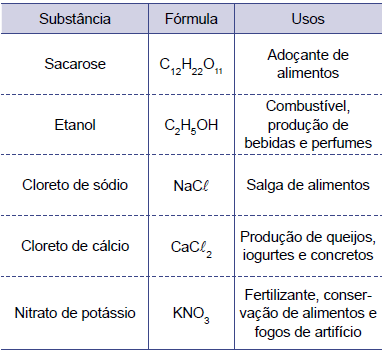
Considere essas substâncias em solução com a mesma concentração em mol/L. A solução com maior ponto de ebulição é a de
cloreto de cálcio.
cloreto de potássio.
nitrato de potássio.
etanol.
sacarose.
O enunciado compara soluções aquosas de mesma concentração molar, mas de solutos diferentes. Nessa condição (mesma molaridade e mesmo solvente), o que diferencia a elevação do ponto de ebulição é o fator de Van’t Hoff (i), que corresponde ao número efetivo de partículas formadas em solução por fórmula do soluto dissolvido.
A fórmula da elevação do ponto de ebulição é:
Com molaridades idênticas e densidade da solução próxima de 1 g/mL, pode-se supor molalidades (m) similares. Portanto, a magnitude de depende essencialmente de i (número de íons):
Estimando i para cada soluto:
Entre as alternativas, o maior i é o do , produzindo a maior elevação do ponto de ebulição e, portanto, o maior ponto de ebulição da solução.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!