Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

O aminoácido glicina , em solução aquosa, pode receber e/ou liberar prótons e se converter em , e . Essas espécies químicas podem participar das reações indicadas a seguir que possuem, respectivamente, e :
Considerando as informações apresentadas, qual o pH do ponto isoelétrico da glicina?
7
Considere as espécies e suas legendas:
Os equilíbrios em questão são:
O pK é o pH no qual as concentrações do ácido e da base conjugada são iguais. Assim, o é o pH no qual e Gly têm a mesma concentração.
Da mesma forma, o é o pH no qual Gly e têm a mesma concentração.
Ao variar o pH de 0 a 14, o gráfico de concentração pH terá o seguinte perfil:
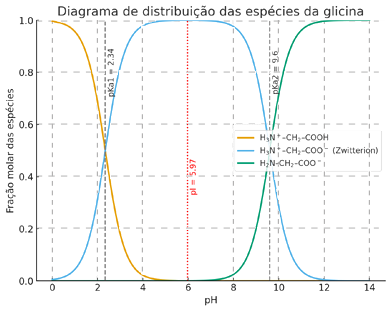
O ponto isoelétrico corresponde ao pH no qual a glicina se encontra na forma zwitteriônica e é definido como a média dos valores de de cada ionização, ou seja:
Nessa situação, a concentração da forma zwitteriônica é máxima e as concentrações das formas protonada (ácida) e desprotonada (básica) são as menores possíveis. Os valores são apenas ilustrativos e não são necessários para resolver a questão.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!