Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

O gás hidrogênio e o gás oxigênio podem ser obtidos a partir da eletrólise da água com uso de uma tecnologia que emprega um eletrolisador com diafragma umedecido com solução de hidróxido de potássio (KOH), denominada hidrólise alcalina da água. A figura representa o esquema desse eletrolisador.
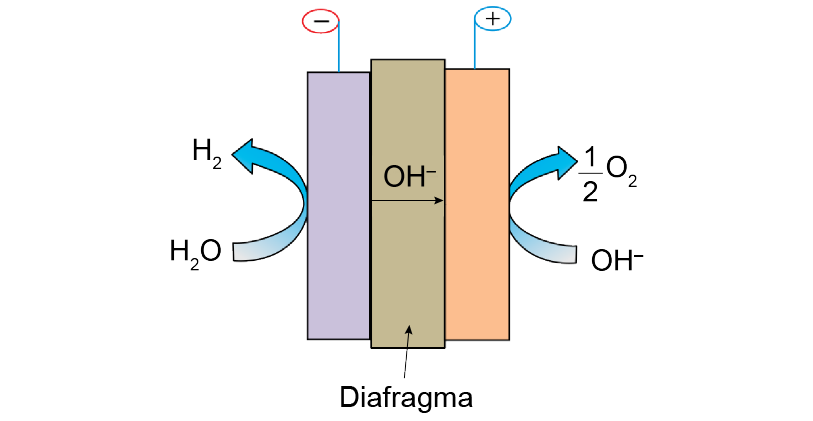
(Shiva Kumar Sampangi e Vurimindi Himabindu. Materials Science for Energy Technologies, 2019. Adaptado.)
As semirreações de redução e os potenciais padrão de redução das espécies envolvidas nessa eletrólise são:
Nesse processo eletrolítico, o gás que é recolhido no cátodo e o valor do potencial teórico mínimo que deve ser aplicado entre os terminais elétricos desse eletrolisador para seu funcionamento são, respectivamente,
A figura mostra a redução da água no polo (–) e a oxidação da no polo (+), sendo assim, no processo de eletrólise, tem-se:
Semirreação (Cátodo de redação, polo(–)):
Semirreação (Ânodo de oxidação, polo (+)):
DDP necessária para que ocorra a reação é calculada pela relação: .
A substância gasosa formada no cátodo é o , e, para ocorrer a reação de eletrólise da água, é necessário que um gerador forneça 1,23V.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!