Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!
Questão ativa
Já visualizadas
Não visualizadas
Resolução pendente
Questão anulada
Sem alternativas
__39114e17-2922-4250-992e-5ddff9b92230.jpg)
Células a combustível microbianas (CCMs) surgiram para contribuir como uma fonte alternativa para a geração de energia. As CCMs utilizam microrganismos eletroativos para transferir elétrons de moléculas orgânicas para um eletrodo. Dentre os substratos orgânicos utilizados para alimentar o compartimento anódico das CCMs e produzir eletricidade, destaca-se o uso da urina humana como fonte alternativa para geração de energia elétrica. Dos sólidos dissolvidos na urina, a ureia é o componente majoritário, podendo chegar a 23 gramas por litro. Como cada pessoa urina em média 2 litros por dia, a produção mundial média de urina chega aos litros/dia, tornando-se um recurso inestimável.
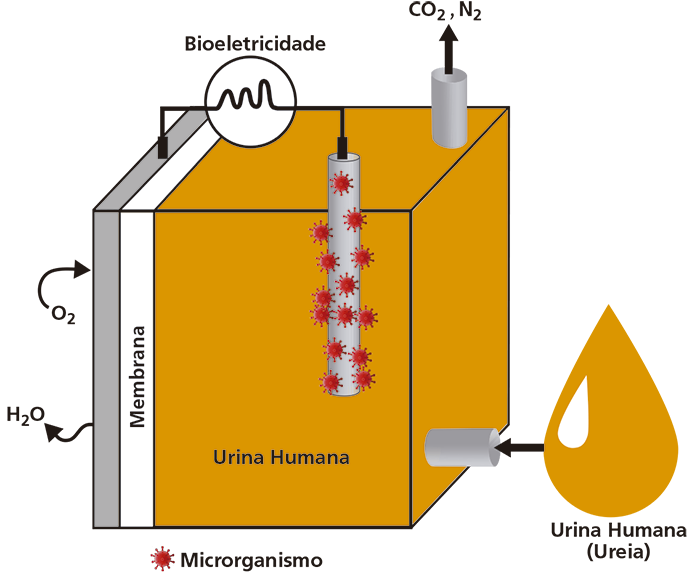
a) A figura ao lado ilustra uma CCM. Em seu compartimento anódico, há um microrganismo agregado ao eletrodo, onde ocorre a transformação da ureia em alguns produtos, entre eles a água. Essa água produzida também sai do sistema, através de uma membrana semipermeável, juntamente com a água da própria urina. Observando a figura ao lado (i) escreva a equação química da reação global que ocorre na CCM e (ii) determine quantos mols de elétrons passam pelo circuito na transformação total de 1 mol de ureia.
b) A ureia, presente na urina, pode ser convertida em fertilizante na forma de íons amônio, se adicionada ao solo. Considerando as informações do texto inicial, qual seria a massa de íons amônio obtida a partir da conversão de 100% da ureia da urina de uma pessoa em um dia?
Dados:
Fórmula da ureia
Número de oxidação (NOX) do nitrogênio na ureia = −3
a) Observando-se as figuras, verifica-se que as substâncias reagentes são a ureia e o gás oxigênio , e os produtos são água , gás nitrogênio e gás carbônico . Desse modo, a equação global que ocorre nessa célula pode ser escrita da seguinte maneira:
Fazendo o balanceamento:
Número de Oxidação do nitrogênio na ureia = –3
Número de Oxidação do nitrogênio no gás nitrogênio = 0
Reação de Oxidação do Nitrogênio:
Desse modo, a variação do Nox é de 3 unidades para cada átomo de nitrogênio.
Como cada molécula de ureia possui 2 átomos de nitrogênio, existe a perda (oxidação) de 6 elétrons.
Portanto, para cada 1 mol de ureia, há 6 mols de elétrons passando pelo circuito.
b) Concentração de ureia na urina = 23 g/L
Total de urina excretada por dia = 2 litros
Massa de ureia encontrada na urina diariamente de uma pessoa =
Proporção na transformação de ureia em íons amônio:
Estequiometria:
x = 27,6 g
A massa de íons amônio obtida diariamente seria de .
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!