Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!
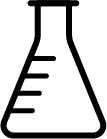
 O frasco Erlenmeyer tem esse nome por ter sido criado por um químico alemão chamado de Emil Erlenmeyer. As características do frasco Erlenmeyer, como fundo chato para não tombar, corpo cônico que permite agitação sem risco de respingos ou vazamentos, e pescoço cilíndrico, que permite a inserção de uma rolha ou tampa para sua vedação, tornaram o frasco popular.
O frasco Erlenmeyer tem esse nome por ter sido criado por um químico alemão chamado de Emil Erlenmeyer. As características do frasco Erlenmeyer, como fundo chato para não tombar, corpo cônico que permite agitação sem risco de respingos ou vazamentos, e pescoço cilíndrico, que permite a inserção de uma rolha ou tampa para sua vedação, tornaram o frasco popular.
Emil Erlenmeyer foi também a primeira pessoa a sugerir a formação de ligações duplas e triplas entre átomos de carbono. Além disso, ele descreveu a regra Erlenmeyer, segundo a qual todos os álcoois nos quais o grupo OH esteja ligado a um carbono insaturado convertem-se em seus isômeros constitucionais de função, aldeídos ou cetonas, uma vez que eles são mais estáveis.
a) Desenhe, no espaço indicado da folha de respostas, um frasco Erlenmeyer.
b) Desenhe, no quadro da folha de respostas, as fórmulas eletrônicas de Lewis dos hidrocarbonetos com duplas e triplas ligações com a menor massa molar possíveis.
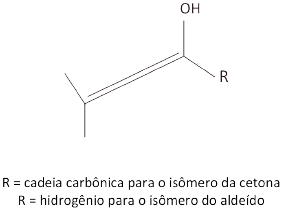
c) Desenhe, na folha de respostas, os isômeros constitucionais de função, cetona e aldeído, da molécula a seguir.
a.
b. As fórmulas eletrônicas de Lewis dos hidrocarbonetos citados são:
Hidrocarboneto com dupla ligação:
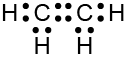
Hidrocarboneto com ligação tripla:
![]()
Logo, preenchendo o quadro, tem-se:
| Hidrocarboneto com dupla ligação | Hidrocarboneto com ligação tripla |
 |
c. Os isômeros constitucionais de função cetona e aldeído da molécula apresentada são:
| Cetona | Aldeído |
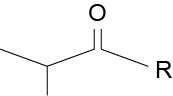 |
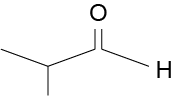 |
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!