Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

Em competições esportivas, os atletas que alcançam as três primeiras posições são condecorados com medalhas denominadas ouro, prata e bronze. Contudo, na Olimpíada e na Paralimpíada de Paris, a composição das medalhas de ouro e de bronze entregues aos atletas, descrita na Figura 1, não corresponde ao que seus nomes sugerem. A medalha de ouro é apenas revestida com esse metal. A medalha de bronze, que deveria ser composta por 67% em massa de cobre e 33% em massa de estanho, possui outra composição.

a) Preencha, no quadro da folha de respostas, qual deveria ser a massa de cada um desses metais, Cu e Sn, em uma medalha olímpica de 437 g para que ela fosse de fato de bronze?
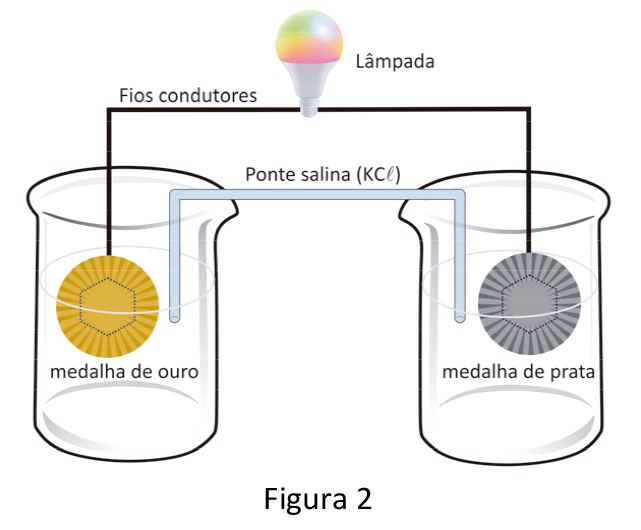
b) Considere que a ginasta Rebeca Andrade, condecorada com medalhas de ouro e de prata em Paris, decida utilizá-las para construir uma pilha. Para isso, ela retirou o hexágono de ferro das medalhas e esquematizou a pilha representada na Figura 2. Sabendo que a atleta dispõe de duas soluções, e , ambas de concentração 1 mol/L, complete, na folha de respostas, em qual compartimento cada solução deve ser adicionada para que a pilha funcione. Com a pilha funcionando, indique qual metal se deposita sobre qual medalha.
c) Um dos problemas da obtenção de Au é o uso indiscriminado de Hg pelo garimpo. Nesse processo, 3 g de Hg dissolvem 1 g de Au para formar um amálgama. O Au é purificado aquecendo o amálgama e evaporando o Hg. Considerando que cada tonelada de sedimento de determinado rio contenha 8g de Au, qual a massa de sedimento necessária para extrair os 6 g de Au presentes na medalha de Au? Assumindo que 60% do Hg evaporado para a produção dessa medalha alcancem um corpo d’água de 6 milhões de litros e que a legislação brasileira adota a concentração de g de Hg/L como limite, esse corpo d’água seria considerado próprio para consumo em relação ao Hg? Apresente os cálculos.
|
Note e adote: |
a. Medalha de bronze: 67% em massa de Cu; 33% em massa de Sn.
m = 437 g
b.
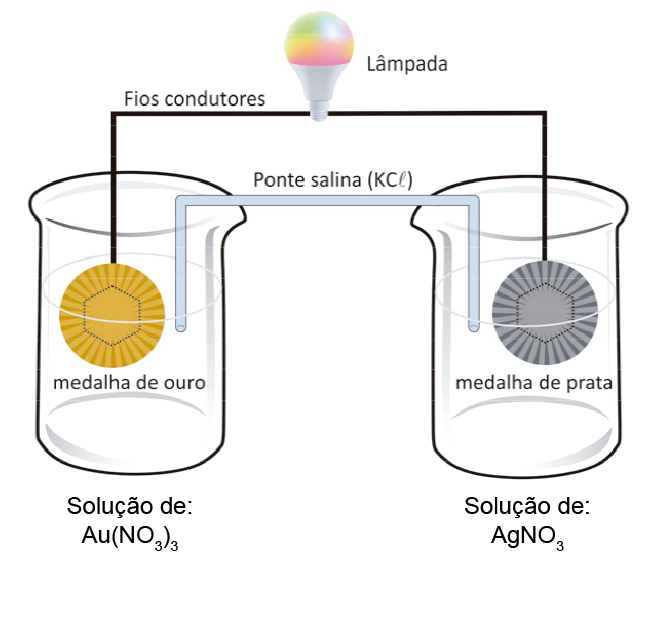
, assim o ouro vai reduzir e a prata, oxidar. As semirreações de redução e oxidação são, respectivamente:
O metal Au se deposita na medalha de ouro, aumentando sua massa. De forma oposta, a medalha de prata irá sofrer corrosão, o que diminui a sua massa.
c. Dados da questão:
, assim o corpo d'água não é considerado próprio para consumo em relação ao Hg.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!