Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

A eletrólise de uma solução aquosa contendo íons e íons foi realizada em uma cuba eletrolítica, na qual circulou uma corrente elétrica contínua de 0,5 A por um período de 2 horas, resultando na obtenção de 0,65 g de cromo metálico.
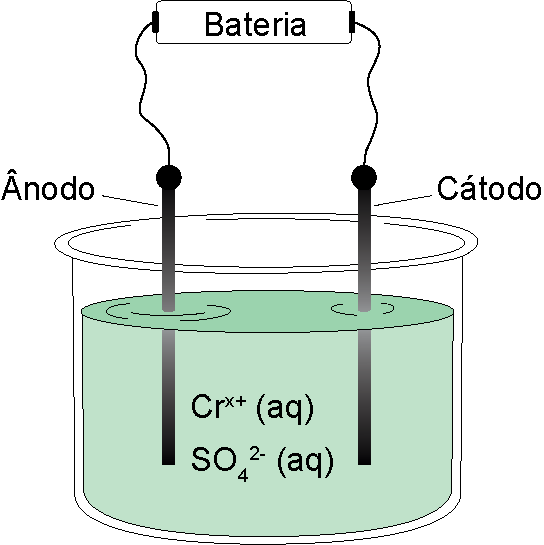
a) Escreva uma proposta genérica que represente a semirreação em que se formou cromo metálico a partir do íon . Em qual eletrodo da cuba eletrolítica ocorreu a deposição do cromo metálico?
b) Calcule a quantidade de carga elétrica, em coulomb, que circulou pela cuba eletrolítica durante o processo de deposição dessa massa de cromo metálico. Sabendo que uma constante de Faraday é igual a 96 500 C/mol de elétrons, determine o valor de x no íon .
a) Redução do cromo:
A deposição do cromo metálico, ou seja, a redução, ocorreu no cátodo.
b) Conversão de horas em segundos: 2 horas = 120 minutos = 7 200 segundos
Massa molar do Cr = 52 g/mol
A ocorrência de redução do cromo é dada por:
Para a redução de 0,65 g de cromo, foram consumidos 3 mol de elétrons; portanto, o valor de x é 3.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!