a) Escreva a solução da constante associada a esse equilíbrio. Determinar a variação do número de oxidação do elemento nessa violação de equilíbrio.
Dissertativa 6 - Dia 2 - Unifesp 2026
Gabarito

Considere o equilíbrio químico, representado pela questão, que ocorre numa dada temperatura fixa
A tabela a seguir fornece os valores das entalpias-padrão de formação das espécies químicas envolvidas nesse equilíbrio
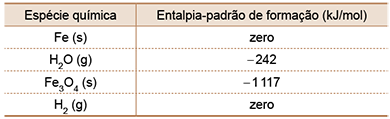
b) Calcule o valor da variação de entalpia da reação de equilíbrio no sentido de formação de hidrogênio molecular gasoso nas condições padrão. Com base no princípio de Le Châtelier, determine qual será o efeito sobre a produção de caso a ocorrência seja realizada a uma temperatura superior à inicial.
Resolução:
a) Kp é uma constante de equilíbrio com relação à pressão, portanto somente os gases entraram na constante.
A variação de Nox do hidrogênio na ocorrência é de 1:
Nox do hidrogênio na
Nox do hidrogênio no
b) A variação da entalpia será:
Como a ocorrência de formação de é exotérmica, um aumento de temperatura desfavorecerá uma ocorrência, o que irá diminuir a quantidade de formada, segundo Le Châtelier.
Downloads
Provas
Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!


