Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!


Em países de clima frio, durante o inverno, é necessário adicionar anticongelante à água de refrigeração do motor de veículos, para evitar o congelamento da água dentro do sistema de arrefecimento do motor.
O anticongelante comumente usado para esse fim é o composto etan-1,2-diol, conhecido como etilenoglicol ().
Quando ele é dissolvido em água, provoca o abaixamento do ponto de congelamento da água, evitando que ela se congele dentro do sistema de arrefecimento do veículo.
O abaixamento do ponto de congelamento de um solvente, , depende da constante crioscópica do solvente, , e da concentração de soluto expressa em termos da quantidade em mol do soluto por quilograma de solvente, a sua molalidade, representada pela letra m, sendo dado pela relação .
A constante crioscópica de um solvente, , é definida como sendo o abaixamento da temperatura de congelamento do solvente provocada pela dissolução de 1 mol do soluto em 1 kg de solvente. A constante crioscópica da água é igual a .
a) Escreva a fórmula estrutural do etilenoglicol. Explique por que etilenoglicol é solúvel em água.
b) Calcule a molalidade (m) de uma solução aquosa que contém 6,2 g de etilenoglicol dissolvidos em 28 g de água.
Determine a temperatura de congelamento dessa solução aquosa, expressa na escala Celsius.
a) A fórmula estrutural do etilenoglicol (etan-1,2-diol) é:
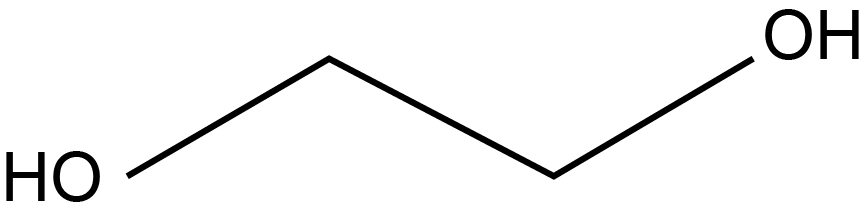
Como há duas hidroxilas em sua estrutura, o etilenoglicol é um composto polar, assim como a água. A hidroxila interage com a água por meio de interações intermoleculares do tipo ligações de hidrogênio, que são muito fortes, o que garante a solubilidade do etilenoglicol em água.
b) A massa molar do etilenoglicol é:
A molalidade m de uma solução aquosa que contém 6,2 g de etilenoglicol dissolvidos em 28 g = de água é:
O abaixamento da temperatura de congelamento dessa solução aquosa é:
Logo, a temperatura de congelamento dessa solução aquosa é:
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!