Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

O ibuprofeno, massa molar = 206 g/mol, é um fármaco utilizado como analgésico e anti-inflamatório. Sua fórmula estrutural está representada a seguir.
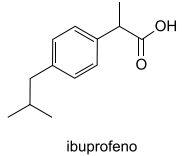
Considere um comprimido que contenha 600 mg de ibuprofeno. Essa dosagem pode ser verificada por titulação direta com uma solução aquosa de , conforme a reação de neutralização representada pela equação química:
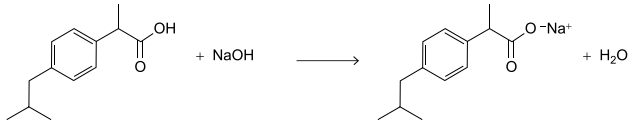
a) Qual é a função orgânica oxigenada que está presente na estrutura do ibuprofeno? Escreva a fórmula molecular desse fármaco.
b) Calcule a quantidade, em mol, de ibuprofeno presente em um comprimido contendo 600 mg desse fármaco. Calcule o volume, em mL, da solução de necessário para neutralizar estequiometricamente essa quantidade de ibuprofeno.
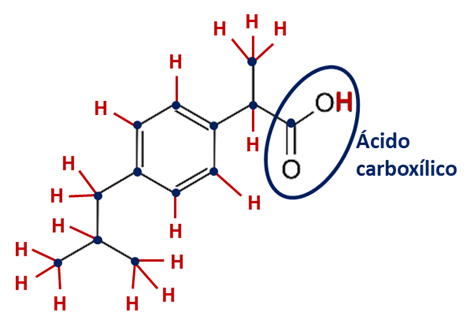
a) A função orgânica presente no ibuprofeno é o ácido carboxílico. A contagem dos átomos de carbono (marcados com círculos na figura abaixo), dos átomos de hidrogênio (indicados com seu símbolo químico, H, na figura abaixo) e dos átomos de oxigênio (O) na estrutura do ibuprofeno nos leva à fórmula molecular .
b) O cálculo da quantidade de matéria (mol) no comprimido de 600 mg (ou 0,6 g) de ibuprofeno é feito com base na sua massa molar:
O cálculo do volume gasto de solução NaOH (V) na titulação começa com um cálculo estequiométrico para determinação da quantidade de NaOH necessária para reagir com o ibuprofeno do comprimido. Entretanto, como a equação apresentada no enunciado aponta que a proporção molar entre os dois reagentes é de 1 : 1 (indicada pelo balanceamento), sabemos que essa quantidade também é de 0,0029 mol. Assim, resta fazer o cálculo que determina em qual volume da solução temos essa quantidade de base:
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!