Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

A bauxita é o principal minério de alumínio. A partir desse minério, obtêm-se diversos compostos de alumínio, dentre eles o hidróxido de alumínio, , a partir do qual se obtém o sulfato de alumínio, . O principal uso desse sulfato ocorre nas estações de tratamento de água (ETA). Outro composto obtido a partir do é a alumina, , a partir da qual é obtido o alumínio metálico, , por eletrólise ígnea. O esquema resume essas informações.
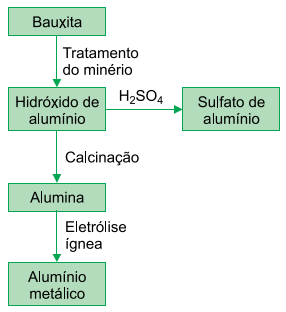
a) Escreva a equação balanceada da reação química que ocorre entre hidróxido de alumínio e ácido sulfúrico produzindo sulfato de alumínio e água. Qual é a função desse sal nas estações de tratamento de água?
b) Represente a distribuição eletrônica em camadas do íon . Considerando a constante de Faraday igual a , calcule a quantidade de carga elétrica, expressa em coulombs, necessária para produzir 54 kg de alumínio metálico pela eletrólise ígnea da alumina.
a) A reação entre o hidróxido de alumínio e o ácido sulfúrico é uma reação de neutralização ácido-base.
O sulfato de alumínio é utilizado nas estações de tratamento de água (ETA) para formar hidróxidos gelatinosos de alumínio, capazes de formar partículas coloidais em suspensão. Esse processo favorece a floculação, a decantação e a posterior filtração, contribuindo para a remoção de impurezas da água.
b)
A distribuição eletrônica em camadas do íon é:
K = 2 ; L = 8.
Para calcular a carga elétrica necessária à produção de 54 kg de alumínio metálico, determina-se inicialmente a quantidade de matéria correspondente:
.
Na eletrólise ígnea, cada mol de Al³⁺ necessita de três mols de elétrons para ser reduzido a alumínio metálico, conforme a semirreação:
.
Logo, a quantidade de elétrons envolvida é:
Utilizando a constante de Faraday , a carga elétrica necessária é:
.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!