Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

A figura representa o esquema de uma pilha formada pelo eletrodo de crômio imerso em uma solução aquosa de nitrato de crômio(III) e pelo eletrodo de platina, metal que não reage nas condições empregadas, imerso em uma solução aquosa de hipoclorito de sódio (NaOC). Ambas as soluções se encontram nas condições padrão de temperatura e concentração.
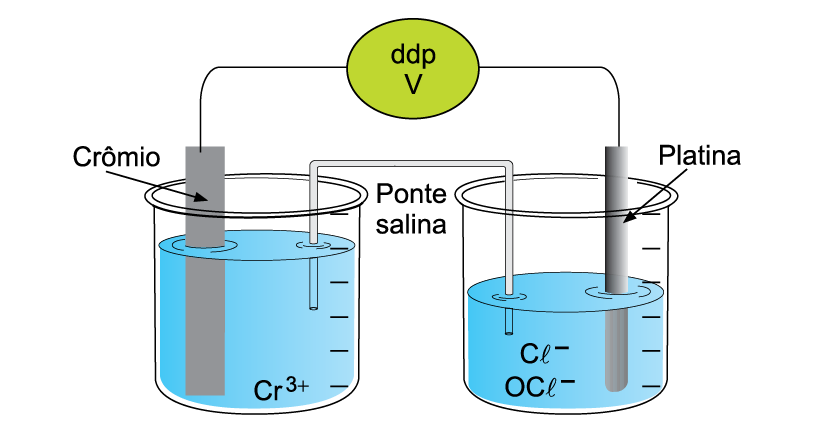
As equações das reações eletroquímicas envolvidas no funcionamento dessa pilha e os respectivos potenciais padrão de redução são:
a) Qual o total de elétrons do íon ? Considerando a fórmula do ânion nitrato, , escreva a fórmula unitária do nitrato de crômio usado na pilha.
b) Apresente a equação da reação da pilha. Calcule o potencial padrão dessa pilha (ddp).
a) Com base na tabela periódica, o átomo neutro do cromo apresenta 24 elétrons . Assim, o cátion trivalente apresenta 21 elétrons. A fórmula unitária é
b) A equação com maior potencial de redução deve ser mantida, e a outra equação, invertida. Além disso, deve-se igualar a quantidade de elétrons que participam nos processos de redução e oxidação, multiplicando a equação envolvendo o cromo por 2 e a equação envolvendo o hipoclorito por 3.
O potencial padrão (ddp) é:
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!