Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

O seguinte experimento foi realizado para analisar alguns conceitos de eletrólise: uma solução aquosa de sulfato de cobre (azul) e uma solução aquosa de dicromato de potássio (alaranjada) foram misturadas em concentrações equimolares, resultando em uma solução de coloração marrom. Essa mistura foi colocada em uma célula eletrolítica em forma de U que foi, então, cuidadosamente preenchida de ambos os lados com uma solução de ácido sulfúrico diluído (incolor). Duas placas de platina foram imersas na solução, uma em cada braço do tubo em U, e conectadas aos polos de uma fonte externa, conforme mostra o esquema da Figura (A). A Figura (B) indica as frações de coloração da solução na célula, após um certo período de eletrólise da solução.
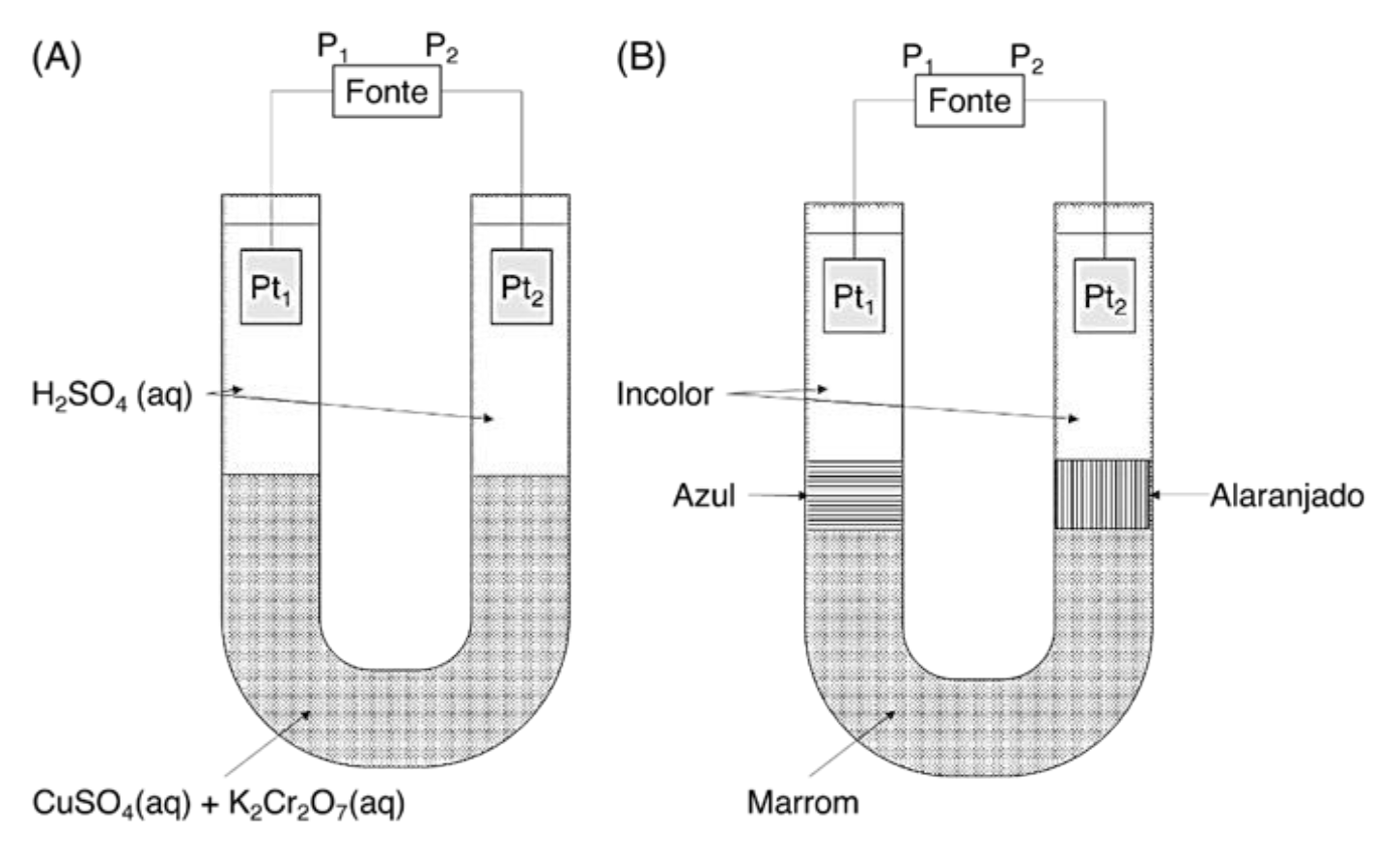
Com base nessas informações, faça o que se pede.
a) Liste todas as espécies iônicas presentes no meio.
b) Explique de forma sucinta por que surgem as camadas de solução de cor azul e alaranjada, observadas na Figura (B), após a eletrólise.
c) Indique qual placa de platina atua como anodo e como catodo e escreva as respectivas semirreações que ocorrem preferencialmente nesses eletrodos.
d) Indique qual dos polos da fonte é positivo, qual é negativo e qual a direção da corrente elétrica.
a) Principais: .
Obs: em quantidades muito pequenas:
b) está ligado ao polo e atrai os cátions da solução (incolor), (incolor) e (azul). Por isso, a solução próxima a vai ficando azulada . Por outro lado, está ligado ao polo e atrai os ânions da solução (incolor) e (alaranjado). Por isso, a solução próxima a vai ficando alaranjada .
c) está atraindo os cátions da solução. Logo, é o catodo e polo da eletrólise.
está atraindo os ânions da solução. Logo, é o anodo e o polo da eletrólise.
As placas estão em contato com a solução de .
Neste caso, têm-se:
d) Do exposto acima, é o polo e é o polo .
Sentido real dos elétrons: para
Sentido da corrente elétrica (convencional): para
__2ebe4c3f-f7a5-424b-b34e-88b77c650c00.png)
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!