Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

Considere um motor-foguete hipotético que utiliza metano criogênico e oxigênio gasoso, funcionando em regime permanente. Nesse motor, uma pequena porcentagem do combustível é injetada (vaporizada) com o oxidante em uma pré-câmara de combustão na qual os gases de combustão (mistura rica em oxigênio) acionam uma turbobomba que pressuriza o combustível a ser queimado na câmara principal, junto com os gases de combustão da pré-câmara.
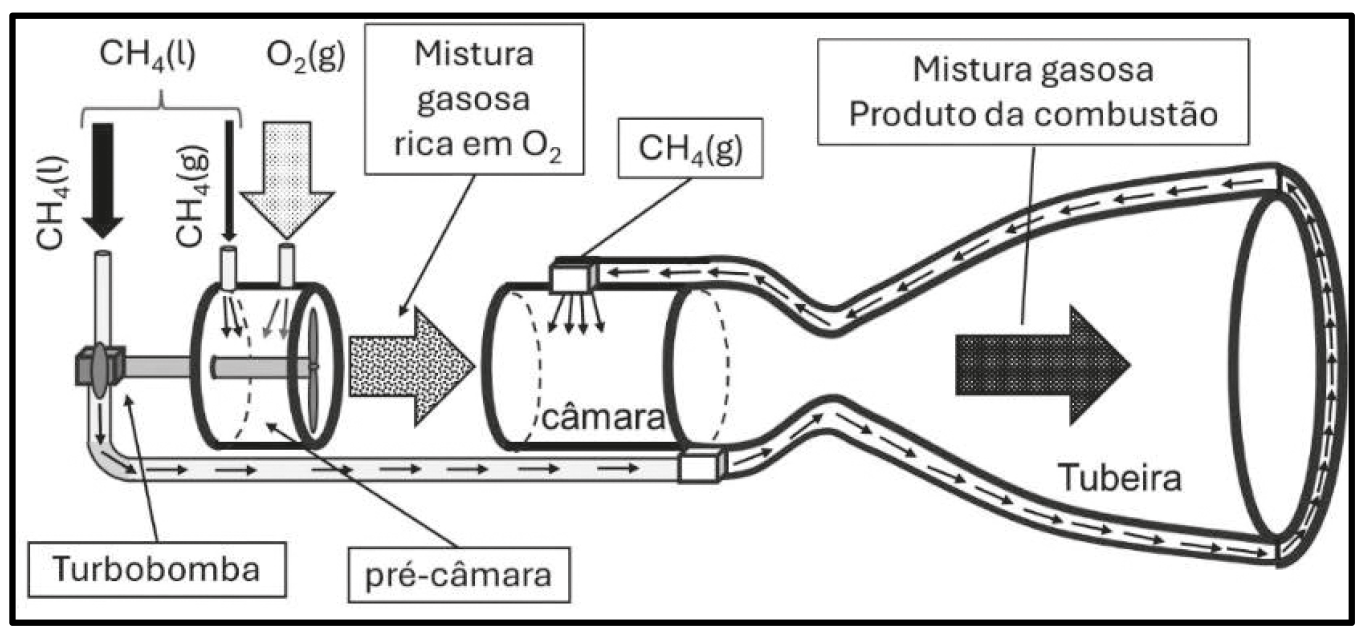
São fornecidos os seguintes requisitos para esse sistema.
I. O calor gerado na câmara de combustão deve ser de 12 MJ. A combustão é completa e gera apenas produtos gasosos.
II. A tubeira (região de exaustão dos gases) absorve 0,25% do calor gerado na câmara de combustão. Esse calor deve ser trocado com , que serve também como fluido de refrigeração, sendo que esse material pode ser aquecido até uma temperatura de 188 K antes de ser injetado, na forma gasosa, na câmara de combustão. Desconsidere o custo de energia na transição de fase do metano, que pode ser realizada por meio da mudança de pressão durante a injeção na câmara principal.
III. A turbobomba opera com uma eficiência de 30%, ou seja, do calor gerado na pré-câmara de combustão, 30% se tornam energia útil para a pressurização do metano. Também considere que, para cada grama de metano a ser pressurizado, a turbobomba precisa gerar 40 J de energia.
São fornecidas as entalpias de formação em : , , e , além da entalpia de vaporização da água . Também são dados o calor específico e a temperatura inicial do metano: e , respectivamente. Considere que os dados termodinâmicos independem da temperatura e pressão.
A partir dessas informações, faça o que se pede.
a) Escreva a equação química balanceada da reação de combustão do metano e calcule a entalpia da combustão, conforme o requisito I.
b) Calcule as massas necessárias, em g, de combustível e oxidante para atender ao requisito I, considerando a reação balanceada do item “a”.
c) Calcule a massa de , em g, que deve ser injetada na pré-câmara de combustão.
d) Calcule a massa mínima de , em g, necessária para resfriar a tubeira, conforme II.
a)
Segundo o enunciado:
Como o calor gerado na câmara de combustão deve ser de , tem-se:
Assim, a equação balanceada, atendendo o requisito I, é dada por:
b)
Como :
c)
Sabe-se que:
pressurizado:
pressurizado:
Mas:
Assim:
d)
Segundo o enunciado, o calor a ser absorvido é . Portanto:
(A massa é mínima, porque se levou em conta a temperatura máxima)
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!