Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

Considere os elementos com as seguintes configurações eletrônicas:
Identifique os átomos e faça o que se pede:
a) Quantos arranjos atômicos são possíveis formar para o ânion (-1), com a composição de 1X, 1G e 1Q?
b) Indique a fórmula molecular de uma molécula com geometria trigonal planar e uma pirâmide trigonal com os átomos descritos acima.
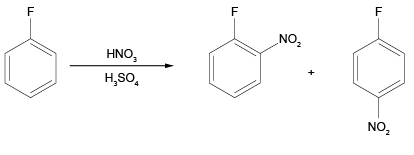
c) O Composto formado por 6X, 5A e 1Y reage com (concentrado), a 25 ºC. Considerando essa reação, desenhe a(s) estrutura(s) molecular(es) do(s) produto(s) principal(is) formado(s).
d) Dadas as moléculas compostas por (i) 2A e 1R; (ii) 2A e 1Q e (iii) 1X, 4A e 1R, coloque-as em ordem crescente de ponto de ebulição.
Identificando os elementos, tem-se:
a) 1X, 1G e 1Q: C, N e S. Como o enunciado pede apenas os arranjos atômicos, sem análise do arranjo de elétrons e formas ressonantes, as possibilidades correspondem a quem seria o átomo central – nitrogênio, carbono ou enxofre: [CNS]-, [NCS]- ou [CSN]-. Na notação do enunciado: [XGQ]-, [GXQ]- ou [XQG]-. Portanto, são possíveis três arranjos atômicos.
b) Geometria trigonal planar: BF3, BH3 ou SO3 são respostas possíveis. Usando a notação do enunciado: ZA3, ZY3 ou QR3.
Geometria pirâmide trigonal (piramidal): NH3 ou NF3 são respostas possíveis. Usando a notação do enunciado: GA3 ou GY3.
c) Composto formado por 6X, 5A e 1Y: C6H5F.
d) (i) 2A e 1R: H2O;
(ii) 2A e 1Q: H2S;
(iii) 1X, 4A e 1R: CH3OH.
O H2S terá a menor temperatura de ebulição, pois trata-se de uma molécula polar com atrações intermoleculares do tipo dipolo permanente. H2O e CH3OH são moléculas polares com atrações intermoleculares do tipo ligação de hidrogênio, mais intensas do que as interações de dipolo permanente. Como H2O realiza mais ligações de hidrogênio por molécula, terá as atrações intermoleculares mais intensas e, por isso, maior temperatura de ebulição.
Assim, a ordem crescente de temperatura de ebulição fica: H2S < CH3OH < H2O.
Na notação do enunciado: (ii) < (iii) < (i).
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!