Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

De modo a estimar o peso atômico de um elemento X, um cientista do século XIX escolheu um procedimento criativo. Ele preparou 4 compostos A, B, C e D contendo o elemento químico X, em proporções mássicas conforme tabela abaixo. Na sequência, transferiu-os, individualmente, para frascos idênticos, previamente evacuados, até que todos atingissem 1 atm de pressão, na temperatura de 525 K, na qual sabia que todos os compostos se comportariam como gases ideais. O cientista repetiu o experimento com nitrogênio, e pesou, então, todos os frascos, mantendo as condições de temperatura e pressão, montando a seguinte tabela.:
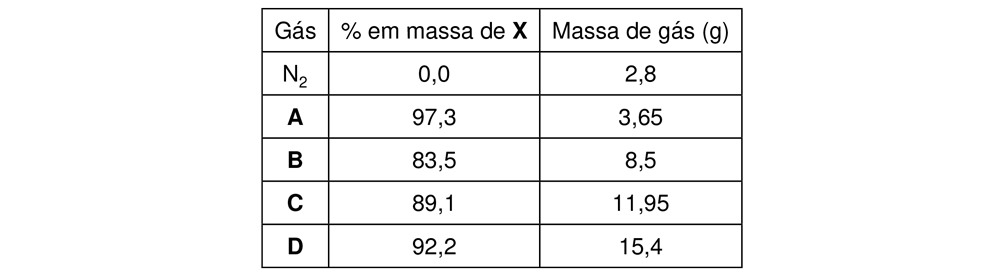
Com base nestas informações, identifique o elemento químico X.
De acordo com a hipótese de Avogadro, como todos os gases ideais estarão nas mesmas condições de pressão, temperatura e volume, eles apresentarão também o mesmo número de mols.
Assim, pode-se determinar o número de mols de presentes no frasco:
.
Portanto, como todos os demais gases apresentam também o mesmo número de mols, pode-se determinar a massa molar de cada um:
.
Assim:
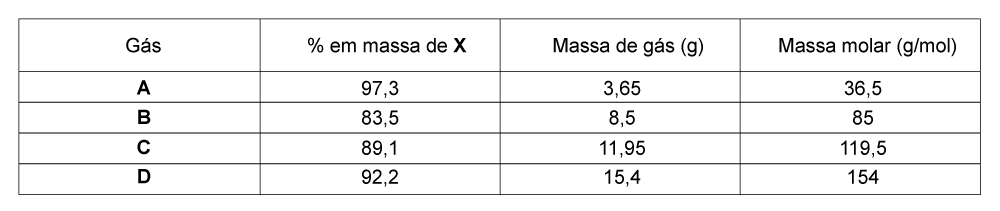
Portanto, dados os percentuais em massa de X em cada composto, pode-se determinar a massa de X por mol de composto, como um múltiplo inteiro (a, b, c ou d) da massa molar de X:
A: .
B: .
C: .
D: .
Verifica-se que: b = 2a; c = 3a e d = 4a. Logo, se a = 1, = 35,5 g/mol.
Consequentemente, X é o elemento químico cloro.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!