Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

Um determinado número de mágica é conduzido em um tanque cilíndrico rígido de parede dupla transparente a 27 °C, em que são injetados os gases metano e oxigênio em sua porção interior, fechada, de 1.400 L; e acrescentada água líquida com corante opaco, ocupando o volume total de sua região anular de 180 L, aberta no topo, conforme indicado na visão esquemática do tanque ilustrada na Figura abaixo:
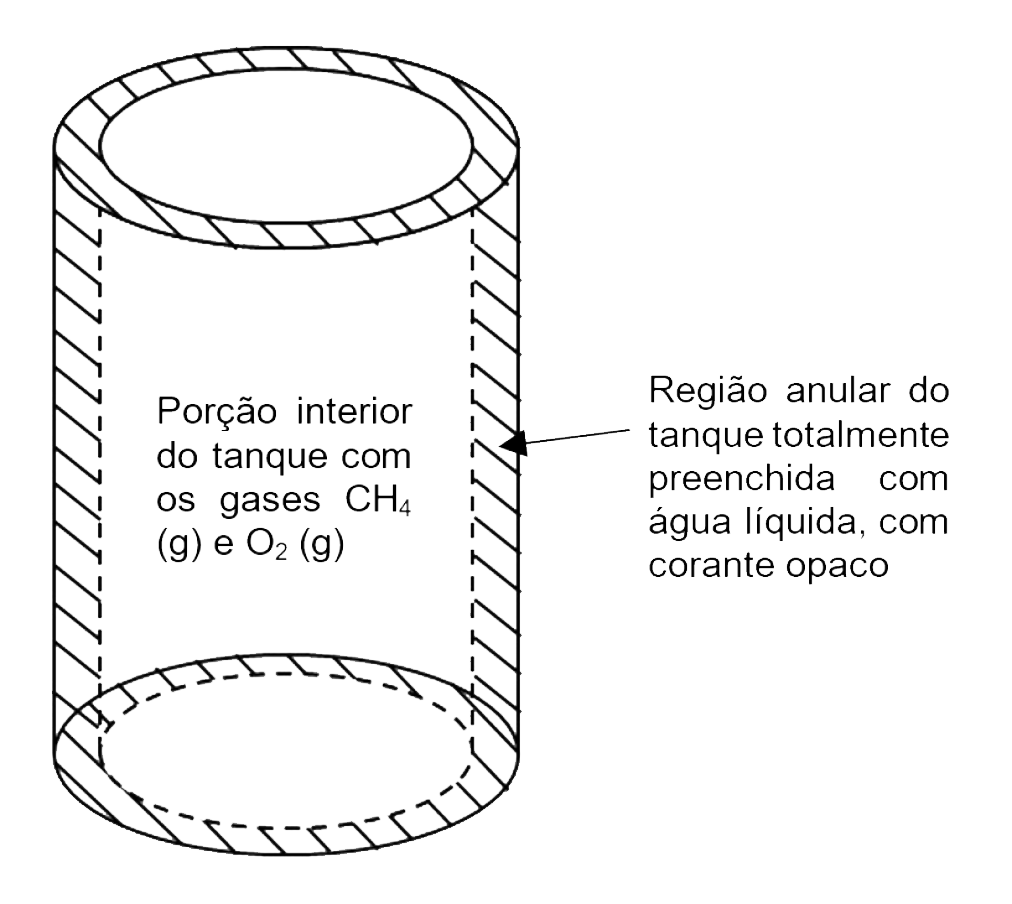
Em resumo, o funcionamento normal do dispositivo para o número de mágica abrange:
Infelizmente, na noite da estreia do espetáculo, o número de mágica não funcionou, revelando uma fumaça escura no interior do tanque, mesmo após a vaporização completa da água na região anular.
Considere que:
i) o sistema composto pela porção interior do tanque e pela região anular é isolado durante a ocorrência da combustão;
ii) a combustão ocorrida no interior do tanque foi incompleta, com formação apenas de , e como produtos;
iii) o corante não afeta as propriedades da água e não adere às paredes do recipiente;
iv) a pressão parcial de , após a combustão, foi de 2,46 atm.
Calcule a razão molar inicial oxidante/combustível, , responsável pelo não funcionamento do número de mágica.
Cálculo do :
O calor absorvido para vaporizar a água foi o valor liberado pela reação.
Logo,
A reação de combustão é dada por:
Logo,
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!