Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!
Questão ativa
Já visualizadas
Não visualizadas
Resolução pendente
Questão anulada
Sem alternativas
__40bc1dcb-7bab-4932-936d-a518bb5c699b.jpg)
A produção enzimática de hidrogênio a partir da glicose e água foi estudada do ponto de vista cinético e termodinâmico, revelando ser possível obter alto rendimento de em condições suaves de reação: temperatura ambiente e pressão atmosférica. Com melhorias tecnológicas e integração com células de combustível, essa tecnologia também permitiria resolver alguns dos desafios associados ao armazenamento, à distribuição e à infraestrutura na economia baseada no .
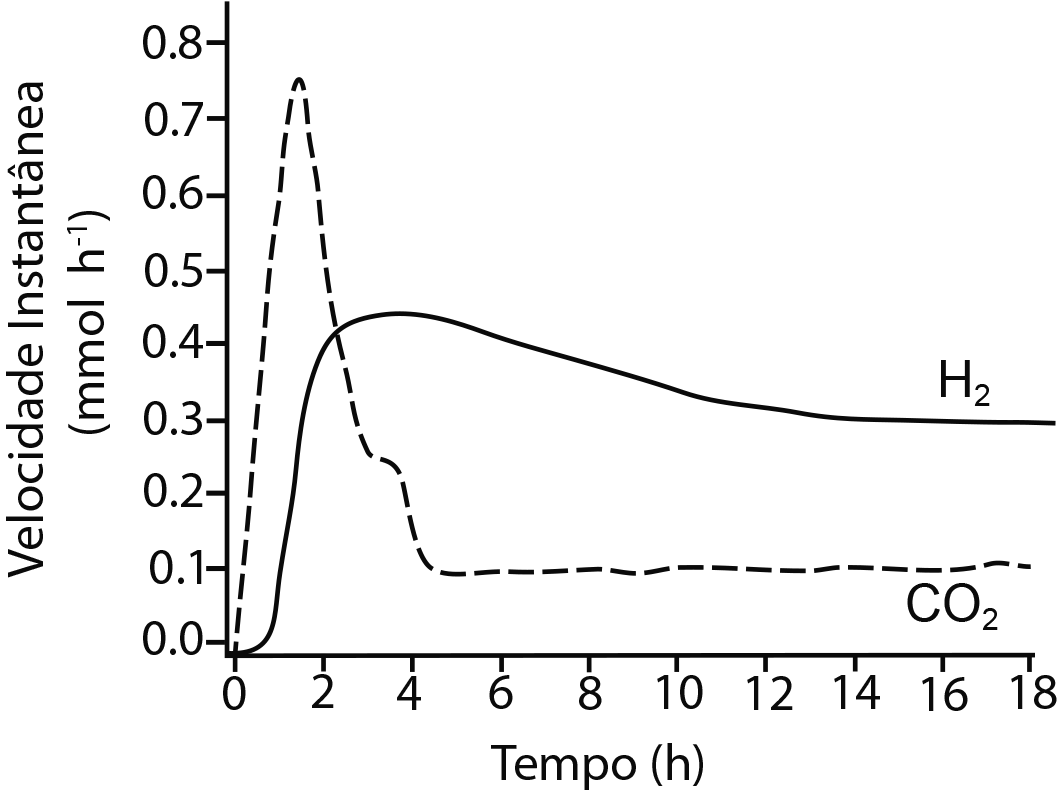
a) A figura ao lado mostra a velocidade instantânea de formação de hidrogênio e dióxido de carbono em função do tempo do processo estudado. A equação química que representa quantitativamente o resultado desse processo é dada por:
Levando em conta essas informações, em que tempo a razão entre as velocidades instantâneas de formação dos produtos se iguala à razão entre seus coeficientes estequiométricos? Justifique.
b) Do ponto de vista termodinâmico, para a discussão dos resultados os autores utilizam o diagrama de energia (aqui incompleto) fornecido no campo de respostas. A partir desse diagrama, resolva: (i) no decorrer do processo sob estudo, o meio reacional tenderia a um aumento ou a uma diminuição da temperatura? Justifique. (ii) Calcule o valor da entalpia molar da reação de formação da água.
a) Cálculo da razão entre as velocidades instantâneas e os coeficientes estequiométricos.
A equação química que rege o processo é:
Os coeficientes estequiométricos indicam que para cada 12 moléculas de H₂ formadas, são produzidas 6 moléculas de CO₂, ou seja, a relação estequiométrica entre os produtos é dada por:
Isso significa que, se a reação estiver ocorrendo de maneira perfeitamente controlada e sem limitações cinéticas, a razão entre as velocidades instantâneas será igual à razão estequiométrica quando a velocidade instantânea do H₂ for o dobro da do CO₂.
Pelo gráfico fornecido na questão, observa-se que a razão entre as velocidades instantâneas de formação dos produtos se iguala no tempo aproximado de 4 horas (velocidade instantânea do e velocidade instantânea do ), conforme demonstrado a seguir.

A análise do diagrama de energia permite concluir que o processo estudado é endotérmico, pois há absorção de calor durante a reação. Isso significa que a energia necessária para romper as ligações dos reagentes é maior do que a energia liberada na formação dos produtos.
Consequentemente, o meio reacional tende a uma diminuição de temperatura, uma vez que a reação retira calor do ambiente para ocorrer.
A confirmação dessa afirmação pode ser feita pelo cálculo da variação de entalpia (ΔH) do processo:
Sabe-se que:
O cálculo da variação de entalpia do processo é dado por:
Como ΔH é positivo, isso confirma que o processo absorve energia, ou seja, trata-se de uma reação endotérmica, o que leva ao resfriamento do meio reacional.
A reação de formação da água pode ser expressa como:
A partir dos dados fornecidos, tem-se:
Como há 12 mols de H₂O sendo formados, dividimos o valor total por 12, ou seja, para obter a entalpia molar:
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!