Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

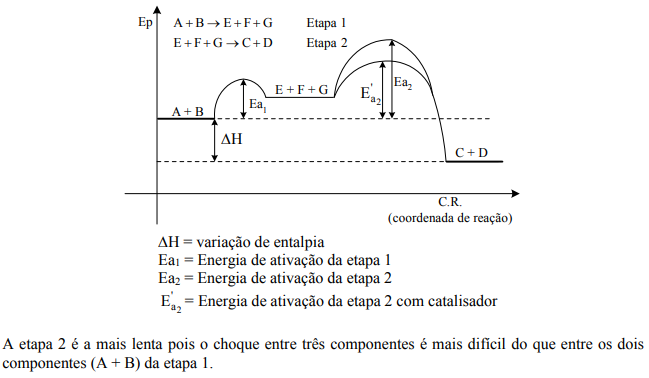
Certa reação química exotérmica ocorre, em dada temperatura e pressão, em duas etapas representadas pela seguinte seqüência das equações químicas:
A + B → E + F + G
E + F + G → C + D
Represente, em um único gráfico, como varia a energia potencial do sistema em transformação (ordenada) com a coordenada da reação (abscissa), mostrando claramente a variação de entalpia da reação, a energia de ativação envolvida em cada uma das etapas da reação e qual destas apresenta a menor energia de ativação. Neste mesmo gráfico, mostre como a energia potencial do sistema em transformação varia com a coordenada da reação, quando um catalisador é adicionado ao sistema reagente. Considere que somente a etapa mais lenta da reação é influenciada pela presença do catalisador.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!