Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

Considere um calorímetro adiabático e isotérmico, em que a temperatura é mantida rigorosamente constante e igual a 40 ºC. No interior deste calorímetro é posicionado um frasco de reação cujas paredes permitem a completa e imediata troca de calor. O frasco de reação contém 100 g de água pura a 40 ºC. Realizam-se cinco experimentos, adicionando uma massa m1 de um sal X ao frasco de reação. Após o estabelecimento do equilíbrio termodinâmico, adiciona-se ao mesmo frasco uma massa m2 de um sal Y e mede-se a variação de entalpia de dissolução (ΔH). Utilizando estas informações e as curvas de solubilidade apresentadas na figura, excluindo quaisquer condições de metaestabilidade, assinale a opção que apresenta a correlação CORRETA entre as condições em que cada experimento foi realizado e o respectivo ΔH.
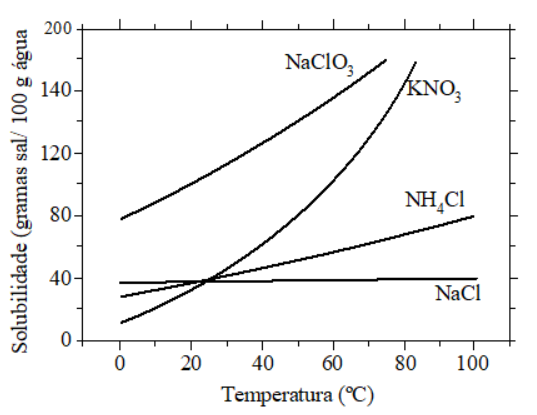
Experimento 1: X = KNO3; m1 = 60 g; Y = KNO3; m2 = 60 g; ΔH > 0
Experimento 2: X = NaClO3; m1 = 40 g; Y = NaClO3; m2 = 40 g; ΔH > 0
Experimento 3: X = NaCl; m1 = 10 g; Y = NaCl; m2 = 10 g; ΔH < 0
Experimento 4: X = KNO3; m1 = 60 g; Y = NaClO3; m2 = 60 g; ΔH = 0
Experimento 5: X = KNO3; m1 = 60 g; Y = NH4Cl; m2 = 60 g; ΔH < 0
Analisando cada caso, temos:
A) Como a adição de m1 saturou a solução, a adição da massa m2 do mesmo composto não resultou em dissolução do sal, logo ΔH = 0.
B) Como a adição de m1 não saturou a solução, a adição da massa m2 do mesmo composto resultou em dissolução do sal. Como a curva de solubilidade é crescente, ΔH > 0.
C) Como a adição de m1 não saturou a solução, a adição da massa m2 do mesmo composto resultou em dissolução do sal. Como a curva de solubilidade é levemente crescente, ΔH > 0.
D) A adição de m1 saturou a solução com relação ao KNO3, mas não saturou com relação ao NaClO3. Portanto, ocorre dissolução deste composto, que apresenta curva de solubilidade crescente, logo ΔH > 0.
E) A adição de m1 saturou a solução com relação ao KNO3, mas não saturou com relação ao NH4Cl. Portanto, ocorre dissolução deste composto, que apresenta curva de solubilidade crescente, logo ΔH > 0.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!