Fique por dentro das novidades
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!

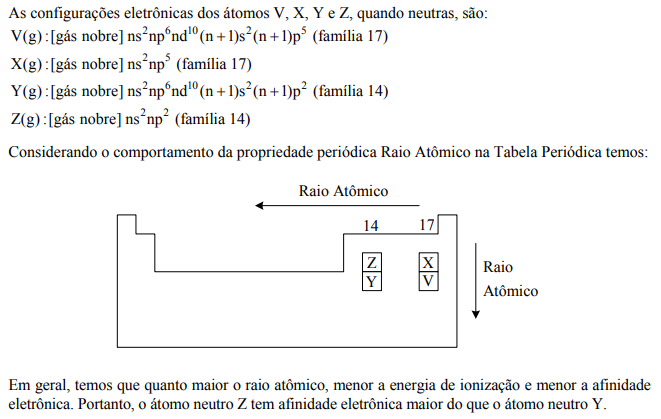
Considere os átomos hipotéticos neutros V, X, Y e Z no estado gasoso. Quando tais átomos recebem um elétron cada um, as configurações eletrônicas no estado fundamental de seus respectivos ânions são dadas por:
Nas configurações acima, [gás nobre] representa a configuração eletrônica no diagrama de Linus Pauling para o mesmo gás nobre, e n é o mesmo número quântico principal para todos os ânions. Baseado nessas informações, é CORRETO afirmar que
o átomo neutro V deve ter a maior energia de ionização entre eles.
o átomo neutro Y deve ter a maior energia de ionização entre eles.
o átomo neutro V deve ter maior afinidade eletrônica do que o átomo neutro X.
o átomo neutro Z deve ter maior afinidade eletrônica do que o átomo neutro X.
o átomo neutro Z deve ter maior afinidade eletrônica do que o átomo neutro Y.
Inscreva-se em nossa newsletter para receber atualizações sobre novas resoluções, dicas de estudo e informações que vão fazer a diferença na sua preparação!